| МЕТОДИЧНІ ВКАЗІВКИ З курсу загальної, неорганічної і біонеорганічної хімії Для виконання завдань із самостійної роботи |
 |
 |
| Учебники методички лекции рабочие программы - Методички, методические указания | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 27.11.11 19:43 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Страница 1 из 5
МЕТОДИЧНІ ВКАЗІВКИ З курсу загальної, неорганічної і біонеорганічної хімії Для виконання завдань із самостійної роботи Під керівництвом викладача З курсу неорганічної хімії для студентів зі спеціальностей: 6.070900 – «Геодезія, картографія і землевпорядкування»; 6.090101 – «Агрономія»; 6.090101 – «Плодоовочівництво і виноградарство"; І курсу біонеорганічної хімії для студентів зі спеціальностей: 6.110101 - "Ветеринарної медицини",
ЗМІСТ
ВАРІАНТИ ЗАВДАНЬ ДЛЯ САМОСТІЙНОЇ РОБОТИ З НЕОРГАНІЧНОЇ ХІМІЇ
ДОДАТОК 6
ВСТУП Методичні вказівки розроблені як допоміжний матеріал до основної навчальної літератури з неорганічної та біонеорганічної хімії (лабораторний практикум із неорганічної хімії для студентів, що проходять підготовку за спеціальностями агрохімія і грутознавство, агрономія, захист рослин, плодоовочівництво і містять контрольні завдання для самостійної роботи під керівництвом викладача та перевірки знань до кожної теми за модульно-рейтинговою системою, а також включають теоретичний матеріал. Для активізації навчального процесу й кращого засвоєння матеріалу в даних вказівках до тем, які запропоновані для самостійної роботи під керівництвом викладача, використані орієнтири трьох типів: Ø Що треба знати; Ø Що треба вміти; Ø Про що треба мати уявлення. Контрольні завдання побудовані таким чином, щоб якомога більше заохотити студентів до самостійного виконання завдань і частково містять питання основного базового матеріалу з неорганічної хімії, а також питання курсу неорганічної та біонеорганічної хімії, які професійно орієнтовані до спеціальності. Ці методичні вказівки рекомендуються для студентів вище перелічених спеціальностей, а також для студентів факультетів ветеринарної медицини, якості й безпеки продукції АПК, здоров'я дрібних тварин. 1 .Основні положення неорганічної та біонеорганічної хімії. 1.1. Основні поняття і закони хімії Методичні поради щодо виконання самостійної роботи. Що треба знати: Ø Визначення понять: "атом", "молекула", "проста та складні речовини", "атомна та молекулярні маси", "моль та молярний об'єм", "валентність", "еквівалент". Ø Зміст основних законів хімії: "закон збереження маси й енергії", "закон взаємозв'язку маси та енергії за А. Ейнштейном", "закон сталості складу хімічних сполук", "закон кратних відношень, як вияв закону переходу кількісних змін у якісні", "закон Авогадро та висновки з нього", "закон еквівалентів". Що треба вміти: Ø Вільно оперувати хімічними поняттями й термінами; Ø Розглядати закони хімії з точки зору атомно-молекулярного вчення; Ø Практично застосовувати знання законів хімії у вирішенні задач. Про що треба мати уявлення: Ø Історичні відомості про розвиток хімії як науки; Ø Найважливіші відкриття в хімії та видатні вчені. Необхідний матеріал із курсу неорганічної та біонеорганічної хімії можна засвоїти при використанні основної рекомендованої літератури [1-3], лабораторного практикуму [4,5], а також, додаткової [6-8]. У хімічних розрахунках використовується кількість речовини - моль. Масу одного моль речовини досить просто вирахувати, якщо відома формула речовини, оскільки чисельно маса 1 моль співпадає з молекулярною масою. Наприклад, 1 моль Н2 – 2 г; НNO3 – 63 г і т. д. Один моль будь-якої речовини містить 6,02·1023 молекул (число Авогадро), але маса одного моль різних речовин - різна. Моль будь-якої газоподібної речовини за нормальних умов (н. у.) займає об'єм 22,4 л. Контрольні завдання: 1. Визначити відносну молекулярну масу речовини й вказати сумарне число атомів у цій сполуці. Приклад: Нітрит кальцію – Са(NO2)2; Mr = ArCa + 2(ArN + 2ArO) = 40 + 2(14 + 2·16) = 136 Сумарне число атомів: 1Ca + 2(1N + 2·О) = 7
2. Вибрати з наведених нижче сполук (частинок): атоми і молекули та зазначити до складних або простих сполук вони належать: Приклад: Н2, SO2, О, PO43-. Н2 – молекула, проста речовина; SO2 – молекула сульфур (IV) оксиду, складна речовина; О – атом оксигену; PO43- – фосфат-аніон, частинка складної речовини. 1.1. Cl2, SO3, SO32-, HCl. 1.5. Fe, Na2SO4, O3, NO3-. 1.2. N2O, O2, CuSO4, S2-. 1.6. Cu, OF2, NO2-, NaCl. 1.3. SO42-, S, P2O5, Ca3(PO4)2. 1.7. F2, NiO, ClO3-, CuO. 1.4. Cl-, H2O, Ar, FeS2. 3. Написати формулу сполуки і вказати масову частку елемента (у відсотках із точністю до десятих). Приклад: Гідроксид кальцію – Са(OН)2; Mr = ArCa + 2(ArО + ArН) = 40 + 2(16 + 1) = 74 Mr (Са(OН)2) – 2 ·ArО; Mr (Са(OН)2) = 74 – 100 % 2 ·ArО = 2·16 – Х %
4. Визначити вміст сполуки у відсотках (із точністю до десятих) у речовині. Приклад: Відносна молекулярна маса H2SO4: Mr(H2SO4) = 1 · 2 + 32 + 4 · 16 = 98 г Молекулярна маса SO3: Mr(SO3) = 32 + 3 · 16 = 80 г Масова частка:
5. Обчисліть відносні молекулярні маси речовин, формули яких: Приклад: O2, КОН, N2O, Na2PbO2; Mr(N2O) = 2·ArN + ArО = 2·14 + 16 = 44; Mr(Na2PbO2) = 2·ArNa + ArPb + 2·ArO = 2· 23 + 207 + 2·16 = 285. 5.1. Н2, ВеО, NН4NО3, Н2С2О4·2Н2О; 5.2. Н2 SO4, V2О5, F2, КАl(SO4)2·12Н2О; 5.3. SCl2, НСN, СО2, ВаСl2·2H2O; 5.4. Fe(OH)3, АsH3, NH4NO2, Са3(PO4)2; 5.5. Ті(SO4)2, SO3, Н2О2, NaCl·HCl; 5.6. КСlO4, Н3ВО3, Na2CO3,·NaHCO3·2H2O; 5.7. Н2S, Сr2S3, СаН2, СО(NH2)2. 6. Яка валентність (ступінь окиснення) елементу в сполуці?
7. У скільки разів молекули речовин в кожній парі відрізняється одна від одної за масою? Приклад: етан С2Н6 – кисень О2; Mr(С2Н6) = 28; Mr(О2) = 32; 7.1. озон О3 – кисень О2; 7.5. бром Вr2 – фтороводень НF; 7.2. водень Н2 – хлор Сl2; 7.6. силан SіН4 – кисень О2; 7.3. азот N2 – етилен С2Н4; 7.7. метан СН4 – фосфін РН3. 7.4. амоніак NH3 – сірководень Н2S; 8. Визначте найпростішу формулу сполуки такого складу (в процентах за масою): Приклад: Калій – 39,7%, Манган – 27,9%, Оксисен – 32,4%. Ar(K) = 39, Ar(Mn) = 55, Ar(O) = 16. KxMnyOz: Остаточна формула: K2MnO4. 8.1. сульфур - 94,11%, 8.5. карбон – 27,27%, Гідроген – 5,88%; оксисен – 72,73%. 8.2. нітроген – 30,43%, 8.6. фосфор – 43,66%; Оксисен – 69,57%; оксисен – 56,34%. 8.3. натрій – 57,5%, 8.7. карбон – 75,0%; Оксисен – 40,0%, гідроген – 25,% Гідроген – 2,5%; 8.4. оксисен – 40,0%, купрум – 40,0%, сульфур – 20,0%. 9. Обчисліть масову частку оксигену в сполуці: Приклад: NaClO3; Mr(NaClO3) = ArNa + ArCl+ 3·ArO = 23 + 35,5 + 3·16 = 106,5; 9.1. SO2, Na2S2O3; 9.5. N2O3, МgCl2·6H2O; 9.2. Са(ОН)2, Н2О; 9.6. LiNO3·3H2O, НРО3; 9.3. N2O, (NH4)2CO3; 9.7. Н4Р2О7, Аl(OH)3. 9.4. NH4NO3, NO2; 10. Визначити валентність або ступінь окиснення елементів у наступних сполуках: Приклад: Cr2O3. Кисень (О) в сполуках має валентність ІІ, в оксидах проявляє ступінь окиснення 2-. У формулі три атоми кисню 3 · (2-) = -6. Сума негативних зарядів = -6. У сполуці сума негативних зарядів дорівнює сумі позитивних зарядів. Маємо два атоми хрому: 2·Х = 6; Х = 3. Ступінь окиснення хрому = 3+. 10.1. СI2O7, Н2Se, SiH4, СuS; 10.5. MoO3, P2O3, OF2, Mn2O7; 10.2. АuCl3, Ва2Si, GeO2, VCl4; 10.6. Ba2Si, B2O3, CuCl, PH3; 10.3. МnO, Мn2O3, АlBr3, АlN; 10.7. Bi2S3, SbCl5, PbI2, CH4. 10.4. AgCl, Cr2S3, TeO2, Ca3N2; 11. Вкажіть ступінь окиснення над символами елементів і складіть формули таких сполук: Приклад: H2SxO3. Кисень проявляє ступінь окиснення 2-, водень 1+: 11.1. NaxPVO3, CrVIOy; 11.5. Cax(PO4)2, NazРV2О7; 11.2. KCrIIIOx, VIIIx(SO4)3; 11.6. Aly(HPO4)3, CrIII(NVOy)3; 11.3. Cax(PO4)2, CIVOy; 11.7. LiVVyO8, ClIxO. 11.4. CrIII(BIIIOz)3, NIII2Oy; 12. Визначити ступінь окиснення елементу в сполуках: 12.1. оксигену – NaClO, OF2, BaO2; 12.2. фосфору – HPO3, H3PO4, HPF6; 12.3. сульфуру – Na2S, Na2S2O3, Na2SO4; 12.4. силіцію – SiH4, SiO2, H2SiO3; 12.5. хрому – K2Cr2O7, Cr(OH)3, K2CrO4; 12.6. феруму – FeCO3, Fe2O3, Fe(OH)3; 12.7. калію – K2S2O5, K2Cr2O7, KMnO4. 1.2. Будова атома. Періодичний закон та періодична система Елементів Д. І. Менделєєва. Хімічний зв'язок і будова молекул. Що треба знати: Ø Сучасні уявлення про будову атома; Ø Поняття про орбіталі, геометричні форми орбіталей; Ø Квантові числа, їх зміст; принцип Паулі; Ø Енергетичні рівні та підрівні; Ø Електронні формули атомів, правило Хунда, правило Клечковського; Ø Валентні електрони атома; нормальний та збуджений стан; Ø Валентність атома; кількісна характеристика валентності; Ø Ступінь окиснення елемента. Ø Взаємозв'язок періодичного закону Д. І.Менделєєва та властивостей хімічних елементів; Ø Основні закономірності зміни хімічних властивостей елементів залежно від положення в періодичній таблиці (у періоді та групі); Ø Типові метали, неметали та елементи з амфотерними властивостями; Ø Визначення валентностей елементів за положенням у періодичній таблиці та будовою атомів; поняття про ступінь окиснення елементу. Що треба вміти: Ø Розрізняти поняття "орбіта" та "орбіталь"; Ø Визначати кількість електронів на енергетичному рівні; Ø Знаходити максимально можливу кількість електронів на даному рівні, підрівні; Ø Визначати число неспарених електронів у нормальному та збудженому станах; Ø Визначати максимальні валентні можливості атомів; Ø Розрахувати ступені окиснення елементів у сполуках. Про що треба мати уявлення: Ø Розвиток теорії про будову атома та стан електрона в атомі; Ø Принцип мінімуму запасу енергії електрона та способи його врахування при складанні електронних формул атомів. Контрольні завдання: 1. Написати електронну формулу атома елементу і його йона з найвищим ступенем окиснення: Приклад: Германій. 32Ge: 1s22s22p63s23p64s23d104p2. Найвища ступінь окиснення германію 4+. Ge4+: 1s22s22p63s23p63d104S04P0. Алюміній; 1.5 Фосфор; Стронцій; 1.6. Флуор; Сульфур; 1.7. Оксиген. Манган; 2. Скільки протонів, нейтронів та електронів містить атом елемента з порядковим номером: Приклад: №15; № 15 – елемент фосфор (Р). р = 15; е = 15; n = Ar – Z = 31 – 15 = 16, (Z – порядковий номер елемента). №18; 2.5. №4 №14; 2.6. №29; №7; 2.7. №20. №34 3. Приклад: Mg2+: 3sо – валентний рівень. Zn2+; 3.5. S2-; Al3+; 3.6. P5+; O2-; 3.7. N2+. Cl7+; 4. Написати електронну формулу елементів згідно правил Клєчковського і Хунда (показати послідовність розміщення електронів по рівням та підрівнями) і вказати кількість неспарених електронів у цьому іоні: Приклад: оксисен – 8О: 1s22s22p4; хром - 24Cr: 1s22s22p63s23p64s13d5. нітрогену та мангану; 4.5. сульфуру та калію; силіцію та купруму; 4.6. карбону та хрому; арсену та літію; 4.7. бору та кобальту. хлору та кальцію; 5. Напишіть електронну формулу атома елементу, вкажіть всі можливі валентності та ступені окиснення елементу у збудженому стані: Приклад: №12. 12Mg: 1s22s22p63s2; Mg*: ст. ок. 2+, валентність II. №13; 5.5. №8; №16; 5.6. №35; №30; 5.7. №26. №11; 6. Напишіть формули вищих оксидів і відповідних гідратів елементів із порядковими номерами: Приклад: №14. № 14 – елемент силіцій (Si). Формула вищого оксиду - SiO2, силану - SiH4. №№16, 34, 52; 6.5. №№19, 32, 16; №№15, 22, 24; 6.6. №№35, 43, 8; №№14, 33, 42; 6.7. №№20, 32, 53. №№35, 14, 24; 7. Вказати номер групи періодичної системи, до якої належить сполука елементу у вищому ступені окиснення: Приклад: RO3: Кисень проявляє ступінь окиснення 2-, у формулі три атоми кисню 3 · (2-) = -6. Сума негативних зарядів дорівнює сумі позитивних зарядів. Тоді елемент R має ступінь окиснення 6+. R2O3; 7.5. R2O5; RCl4; 7.6. HR; RH3; 7.7. R2O7. RO2; 8. Як змінюються величини зарядів ядер, радіуси атомів, електронегативність і ступені окиснення елементів? Які закономірності цих змін по групі зверху вниз або по періоду зліва направо? Як змінюється в цьому напрямку металічність елементів і характер оксидів та гідроксидів? Елементи 2 періоду; 8.5. Елементи 2А періоду; Елементи 3 періоду; 8.6. Елементи 6А періоду; Елементи 4 періоду; 8.7. Елементи 7В періоду. Елементи 4А періоду; 9. До якого елементу зміщені спільні електронні пари у відповідній сполуці. Вкажіть його атомну масу: Приклад: Розглянемо молекулу Сl2O. EH(Cl) = 3,0; EH(О) = 3,5. Різниця ЕН складає 3,5 – 3,0 = 0,5 < 1,7. При утворенні молекули неспарені електрони атомів хлору утворюють спільну електронну пару, зміщену до кисню. H2S; 9.5. Ca3P2; Be2C; 9.6. Mg2Si; Cl2O7; 9.7. SiF4. B2O3; 10. Скільки спільних електронних пар утворюють зв'язки у молекулі: Ca3N2; 10.5. HCN; C2H6; 10.6. CO; Cl2O; 10.7. SiCl4. CCl4; 11. Користуючись даними таблиці відносних електронегативностей елементів, розрахуйте, який зі зв'язків характеризується найбільшою мірою йонності (розрахувати ступінь іонності І,% якщо вважати, що 50% іонного зв'язку відповідає різниці між електронегативністю 1,7): Приклад: K і О. EH(К) = 0,8; EH(О) = 3,5. Різниця ЕН складає 3,5 – 0,8 = 2,7. K і Cl, O і Cl; 11.5. O і Ca, O і K; S і H, N і H; 11.6. Al і Cl, Fe і Cl; Ca і H, Si і H; 11.7. O і Na, H і І. Li і Br, Ca і Cl; 12. Напишіть структурно-графічну формулу сполуки і вкажіть типи хімічних зв'язків між атомами: Приклад: Na2SO4. EH(S) = 2,5, EH(О) = 3,5, EH(Na) = 0,9. NaOH; 12.4. Co(OH)3; Mg3(PO4)2; 12.5. Ca(NO3)2; K2SO4; 12.6. H2SO3; 12.7. KMnO4.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Последнее обновление 27.11.11 21:10 |

 %
%
 Разів.
Разів.
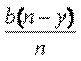 .
. Написати електронну структуру іона елементу:
Написати електронну структуру іона елементу: ;
;  . Йонного 79,4%, ковалентного 100 - 79,4 = 20,6%.
. Йонного 79,4%, ковалентного 100 - 79,4 = 20,6%. Різниця DЕН(S-O) складає 3,5 – 2,5 = 1,0 < 1,7 – ковалентний полярний зв'язок; DЕН(Na-O) = 3,5 – 0,9 = 2,6 > 1,7 – йонний зв'язок.
Різниця DЕН(S-O) складає 3,5 – 2,5 = 1,0 < 1,7 – ковалентний полярний зв'язок; DЕН(Na-O) = 3,5 – 0,9 = 2,6 > 1,7 – йонний зв'язок.


